Панкреатит и сахарный диабет
Сахарный диабет (СД) – это сложное, комплексное заболевание, характеризующееся нарушением всех видов обмена веществ, развитием сначала относительной, впоследствии абсолютной инсулиновой недостаточности с поражением всех органов и тканей. Основное место занимает сахарный диабет 2 типа с относительной инсулиновой недостаточностью, у 5–10% больных наблюдается сахарный диабет 1 типа, обусловленный аутоиммунной деструкцией β-клеток с развитием абсолютной инсулиновой недостаточности.
На сегодняшний день наиболее чаще встречается специфический тип сахарного диабета на фоне острого и хронического панкреатита (ХП), что характерно для пациентов молодого трудоспособного возраста от 25–30 до 50 лет (1, 2). В основе этиологии острого и хронического панкреатита лежит алкогольное отравление, пищевая интоксикация, патология печени, желчевыводящей системы (дискинезия, холецистит, желчно-каменная болезнь), гиперлипидемия.
Острый панкреатит (ОП) в 10% случаев переходит в хронический, а учитывая значительное количество эпизодов нераспознанного ОП, ХП наблюдается гораздо чаще. При ОП примерно в 50% случаев развивается транзиторная гипергликемия, что связывают со значительным повышением базальной или стимулированной секреции глюкагона. Устойчивая гипергликемия наблюдается у 15% больных, по мере разрешения ОП гликемия нормализуется через 4–6 месяцев. Однако наблюдается и тяжёлое течение СД при остром рецидивурующем панкреатите с гипоинсулинемией и гиперглюкагонемией, что требует инсулинотерапию. Эти пациенты должны находиться под наблюдением, т. к. даже малые дозы инсулина приводят к быстро развивающейся гипогликемии, гипогликемической коме вследствие соблюдения строгой диеты, нарушения механизма глюкагоновой контррегуляции и наличия синдрома мальабсорбции.
При ХП синдром эндокринного нарушения проявляется в 2-х противоположных вариантах: гиперинсулинимизм и сахарный диабет.
Гиперинсулинимизм набюдается на ранних стадиях ХП и характеризуется гипогликемическим состоянием при нормальном или умеренно повышенном уровне инсулина и нормальном уровне глюкагона, что объясняется полинезией (увеличением островков Лангерганса), или макронезией (островки большего размера).
Позднее может развиться относительная гиперинсулинемия вследствие истощения продукции глюкагона. Иногда при ХП базальный уровень глюкагона в норме или умеренно повышен, но секреторные ответы на аминокислотную стимуляцию или инсулиностимулирующую гипогликемию, как правило, снижены.
С прогрессированием заболевания развивается гипоинсулинемия и гипоглюкагонемия, что связано с уменьшением массы островковых клеток.
Преходящая гипергликемия может быть выявлена при обострении ХП, что объясняется отёком поджелудочной железы и ингибирующим влиянием трипсина (уровень которого повышается при ОП и обострении ХП) на продукцию инсулина.
При стихании обострения панкреатита уровень глюкозы в крови нормализуется. Степень нарушения углеводного обмена у больных с ХП колеблется в широких пределах: от нарушения толерантности к глюкозе до инсулинозависимого СД.
Нарушение толерантности к углеводам развивается на ранней стадии ХП. СД может также сформироваться в начале клинической манифестации ХП, но всё же чаще устойчивое нарушение развивается через несколько лет.
СД на фоне ХП характеризуется прогрессирующим разрушением поджелудочной железы, в том числе и атрофией островковых клеток, замещением их соединительной тканью.
Клиническая картина может имитировать как СД 1 типа, так и СД 2 типа (15, 16). Согласно литературным данным СД на фоне панкреатита развивается от 10 до 90% случаев, причём в половине случаев является инсулинозависимым.
Распространённость и заболеваемость СД на фоне ХП зависит от географических условий, длительности и вида панкреатита. При длительном бессимптомном течении ХП, при отсутствии обострения вторичный сахарный диабет развивается примерно в 5% случаев.
Однако при хроническом рецидивирующем течении панкреатита частота нарушения толерантности к глюкозе наблюдается у 25–30% больных в течение 20 лет, у 40–50% развивается СД.
Было замечено, что при некальцифицирующем хроническом панкреатите частота случаев нарушения толерантности к глюкозе составляет 50%, а сахарный диабет развивается у 30 % больных. При кальцифицирующем хроническом панкреатите частота случаев больше и составляет соответственно 90 % и 61 %.
Раннее развитие кальцификации поджелудочной железы является независимым фактором риска формирования СД с увеличением зависимости от инсулина более чем в 3 раза.
Клиническое течение СД на фоне ХП имеет свои особенности. Пациенты, как правило, правильного телосложения, пониженного питания, нет связи с семейной предрасположенностью, ожирением. Симптомы диабета (сухость во рту, жажда) обычно появляются через определённое время после начала болевых приступов.
Сахарный диабет при панкреатите протекает легче «эссенциального». Потребность в инсулинотерапии в начале заболевания сравнительно невысокая, редко развивается кетоацидоз, отмечается склонность к гипогликемическому состоянию.
Согласно литературным данным и долгой врачебной практики, нами замечено, что в патогенезе сахарного диабета большую роль играет тотальное поражение поджелудочной железы с параллельно идущей патологией печени и желчевыводящих путей. Именно патология печени (стеатоз) и объясняет частые гипогликемические состояния и высокую чувствительность к инсулинотерапии при панкреатите.
Рис. 1 иллюстрирует анатомическую, биологическую и химическую взаимозависимость печени и поджелудочной железы.
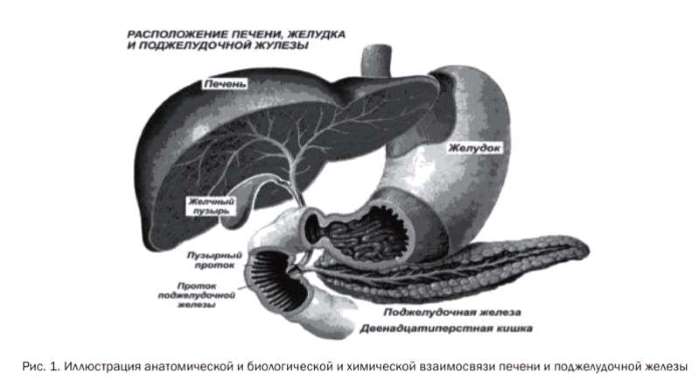
Печень занимает ключевую позицию в поддержании гомеостаза, играет важную роль в адаптационных условиях, поддерживает межорганные и межсистемные связи.
Глюкоза, абсорбированная в желудочнокишечном тракте, через портальную вену поступает в печень. Глюкоза стимулирует выброс инсулина сама и посредством секреции ряда гормонов желудочно-кишечного тракта: гастрин, секретин, панкреозимин, глюкагон, желудочный ингибиторный полупептид, глюкозозависимый инсулинопептид.
Глюкоза в печени превращается в гликоген. Гликоген печени является главным источником энергии центральной нервной системы.
Прежде, чем поступить в периферическую циркуляцию, инсулин через портальную вену проходит через печень. Причём в ней задерживается 40–50% гормона натощак, при стимуляции глюкозой количество задерживаемого инсулина в печени может достигнуть 80–90%. Чем выше секреция инсулина – тем больше его задерживается в печени.
Биологический период полураспада инсулина составляет 7–15 минут. Основную роль в инактивации инсулина играет печень – до 80%. Глюкагон, секретируемый α-клетками островков Лангерганса, сначала попадает в межклеточное пространство и интерстициальную жидкость, а затем с током крови через портальную вену – в печень.
Основное глигогенолитическое действие глюкагона происходит в печени, где он связывается с рецепторами гепатоцитов и активизирует аденилатциклазу, которая переводит АТФ в ц-АМФ. Глюкагон стимулирует гликогенолиз, снижает утилизацию глюкозы и синтез гликогена, повышает глюконеогенез и образование кетоновых тел.
Результатом всего вышеизложенного является повышенное образование глюкозы и выход её из печени. В периферических тканях глюкагон оказывает липолитическое действие, повышая липолиз, снижая липогенез и белковый синтез. Концентрация глюкагона в портальной вене колеблется от 300 до 4500 пг/мл, тогда как в периферической крови – до 90 пг/мл. Разрушение глюкагона происходит главным образом в печени, менее в почках, в целом – около 0,5 мг/сутки.
При нормальном состоянии α- и β-клеток поджелудочной железы, при нормальном состоянии печени гипогликемия не развивается даже при длительном голодании. При ограниченном поступлении глюкозы (углеводов) уже через 40–48 часов содержание глюкагона в крови возрастает на 50–100 % по сравнению с его содержанием Рис. 1.
Это синхронно сопровождается снижением инсулинемии, соотношение уровней инсулина и глюкагона уменьшается до 0,4 (в норме – 3,0). Повышенное образование глюкагона ведёт к усилению гликогенолиза, глюконеогенеза и уменьшению запаса гликогена. Снижение секреции инсулина стимулирует липолиз, повышенное содержание глюкагона ускоряет образование кетоновых тел из жирных кислот.
Однако нельзя согласиться, что основное депо гликогена содержится в мышцах. Габариты депо печени трудно сравнить с оными в мышцах. Глюкоза, всосавшаяся в желудочно-кишечном тракте, поступает через портальную вену в печень.
Именно печень, а не мышцы, играют основную роль в метаболическом процессе, именно печень является основным депо энергии за счёт несоизмеримого кругооборота обмена веществ. Отсюда первоочерёдность в развитии инсулинорезистентности дозволено рассматривать в клетках печени. Резервные возможности печени очень велики. Однако, при жировом гепатозе вследствие дистрофии гепатоцитов на фоне нарушения клеточного метаболизма (окислительно-восстановительного процесса) могут наблюдаться частые (тощаковые) гипогликемические состояния.
Гипогликемические реакции при жировом гепатозе могут быть связаны с истощением запасов гликогена в печени, параллельно идущей патологией поджелудочной железы и дисбалансом между печенью и поджелудочной железой.
Патогенез жирового гепатоза сложен. Накопление жира в гепатоцитах происходит в том случае, если образование триглицеридов превалирует над синтезом липопротеинов и секрецией последних из гепатоцита в виде ЛОНП.
В развитие жирового гепатоза могут включаться эндогенные и экзогенные механизмы. По мере снижения гликогена в печени и накопления жира печёночная клетка становится всё более уязвимой и чувствительной к токсическим влияниям.
В нормальной печени содержание жира не превышает 1,5 % от её массы, и он не обнаруживается при обычном гистологическом исследовании. Мелкие капли жира в гепатоцитах начинают определяться при световой микроскопии, если его количество возрастает до 2–3 %, что расценивается как жировая инфильтрация печени (стеатоз). Основные компоненты гепатоцеллюлярных липидов представлены триглицеридами, субстратами для синтеза которых являются жирные кислоты и глицерофосфат.
Жирные кислоты поступают в гепатоцит из нескольких источников: из пищевого жира и в результате липолиза жировой ткани. Печёночная клетка способна и самостоятельно синтезировать жирные кислоты из ацетилкоэнзима А, особенно при избытке последнего. Источниками глицерофосфата в гепатоците являются глицерин, образующийся при гидролизе липидов, и глюкоза, которая в ходе гликолиза превращается в фосфатидную кислоту, запускающую реакции синтеза триглицеридов.
Таким образом, продукция триглицеридов в гепатоците находится в прямой зависимости от содержания в нём глюкозы, жирных кислот и ацетилкоэнзима А. Жировой гепатоз характеризуется жировой дистрофией гепатоцитов. Наиболее вероятной причиной жирового гепатоза является лишний вес, патология поджелудочной железы, заболевания желудочно-кишечного и билиарного трактов и др. Одним из наиболее частых нарушений жирового обмена с избыточным накоплением жира в печени является кетоз.
Повышенное образование кетоновых тел в результате нарушения метаболизма при частых гипогликемических состояниях на фоне несоблюдения режима питания (приём пищи 1–2 раза в сутки), вынужденного голодания, переедания, употребления в большом количестве легкоусвояемых углеводов, жиров, алкоголя, никотина, кофеина, передозировки сахароснижающих препаратов и др.
Жир в клетках печени откладывается в результате избыточного поступления в печень свободных жирных кислот (СЖК), снижения скорости окисления СЖК в метахондриях гепатоцитов; избыточного образования и всасывания СЖК в кишечнике; пониженного синтеза липопротеинов разной плотности в самой печени; функциональной печёночной недостаточности, обусловленной заболеванием печени.
Параллельно жировому гепатозу (стеатозу), следственной инсулинорезистентности гепатоцитов на фоне тех же экзо- и эндогенных факторов идёт патологический процесс в поджелудочной железе. По нашему мнению, инсулинорезистентность заключается в неспособности печени обеспечить постоянно нормальный уровень сахара в крови в течение суток.
Мы рассматриваем первостепенность инсулинорезистентности в поражённых, «уязвимых» клетках печени, которая не справляется полностью со своей обязанностью в метаболическом процессе. Базируем это заключение на быстрой клинико-метаболической компенсации СД, относительной нормализации размеров и функции печени и поджелудочной железы на фоне проводимого нами комплексного лечения в стационаре и поддерживающего профилактического в амбулаторных условиях пожизненно.
Взяв в основу многогранность патогенеза сахарного диабета, увидев причинно-следственную связь в развитии заболевания, мы предоставляем свою методику лечения сахарного диабета на фоне панкреатита, сложившуюся на базе долгого стационарного и амбулаторного ведения пациентов.
Для предупреждения прогрессирования заболевания, раннего становления осложнений, лечение сахарного диабета должно быть комплексным.
Фундаментом является строгий режим питания и диета (Стол Д – П ), полное исключение диетонеприемных продуктов (чипсы, кириешки), кофе, напитков (кока-кола и др.), устранение сусли, фрусли, ограниечение легко усвояемых углеводов (фруктоза, сорбит и др.). Щадящий вариант содержит физиологическую норму белка (1/3 белка животного происхождения) с ограничением жира и углеводов.
Пища готовится на пару или даётся в отварном виде тёплой, жидкой или полужидкой консистенции. Употребление в большом количестве фруктов и овощей, при чём ограничение помидоров, исключение винограда, бананов, фиников, инжира, томатного, других соков, где консервантом являются углеводы.
Рекомендуются кисло-сладкие фрукты: яблоки (антон), грейпфрут, киви, лимон; отечественные ягоды (черника, голубика, чёрная смородина, вишня, калина, рябина, брусника, клюква и др.). Режим питания – дробный – 6 раз в сутки.
В медикаментозное лечение сахарного диабета для быстрой клинико-метаболической компенсации должно входить:
- инфузионная терапия: реополиглюкин (полиглюкин и др.) 400,0 мл в/венно-капельно № 6;
- гепатопротекторы (эссенциале-форте, эссенцикапс, гептрал, гептал, легалон) в течение 2-х месяцев;
- ферменты (панкреатин, панзинорм, креон). 3 раза в день после еды;
- парентеральное введение витаминов группы В, С;
- антибактериальные препараты (антибиотики или нитрофураны) в течение 10–14 дней каждого месяца вследствие часто сопутствующей инфекции (хронический пиелонефрит, тонзиллит);
- симптоматическое лечение (при горечи во рту – желчегонные, при нарушении сна – седативные и др.);
- сахароснижающие препараты – инсулинотерапия (инсулин короткого действия в малых дозах), при положительной динамике – перевод на сульфаниламидные препараты (диабетон MR, диадеон, гликлазид), тиазолидиндионы.
Пример № 1: Больной О., 39 лет, был доставлен СП на стационарное лечение в хирургическое отделение 3-ей ГКБ г. Минска с диагнозом: Острый панкреатит.
Эндокринолог был вызван в экстренном порядке по поводу гипогликемического (прекоматозного) состояния пациента, в 1000 гликемия – 1,8 ммоль/л после самостоятельного введения инсулина на дому. Больной жаловался на тошноту, чувство тяжести в правом боку, плохой сон, раздражительность, онемение пальцев ног, частые судороги, похудание на 10 кг в течение полугода. Считает себя больным сахарным диабетом около года, когда на стационарном лечении по поводу острого панкреатита был выявлен СД и назначена инсулинотерапия: Протамин 2100 – 4 ЕД, Моно-инсулин 800 – 6 ЕД, 1400 – 6 ЕД, 1900 – 6 ЕД п/кожно.
Самочувствие ухудшилось 2 дня назад после съеденного салата (помидоры со сметаной): появилась тошнота, рвота, резкие боли в животе, понос.
Из перенесенных заболеваний отмечает инфекционный гепатит, частые простудные заболевания. Объективно: больной правильного телосложения, нормального питания, рост 168 см, вес 59 кг. Кожные покровы влажные, со слабым желтушным оттенком. Щитовидная железа не увеличена, безболезненна, подвижна при акте глотания. Тоны сердца ясные, Ps -110 у д. в 1 мин, ритмичен, АД 100/65 мм рт. ст. В лёгких дыхание везикулярное, хрипов нет, ЧД – 22 в 1 мин. Живот мягкий, печень на 4 см выступает из-под правого края рёберной дуги, болезненна при пальпации. Симптом поколачивания по пояснице слабо положителен с обеих сторон. Стул был вчера, понос. Пульсация на а. tibialis posterior d., s. ослаблена.
Биохимический анализ крови: билирубин общий – 28,6 мкмоль/л, мочевина – 8,8 ммоль/л; глюкоза – 4,0 ммоль/л, амилаза – 450 ммоль/л. Общий анализ крови: Er – 3,3 ·1012/л, Hb – 116 г/л, L – 10,8 ·109 /л, б – 1%, п – 6 %, э – 7%, с. – 51%, л. – 24%, м. – 12 %, СОЭ – 22 мм/час. Общий анализ мочи: с/ж, удельный вес 1014, лейкоциты 6–8/1, белок, сахар – нет, бакт. +, ацетон – отр. КТ: признаки хронического кальцифицированного панкреатита с увеличением парапанкреатических лимфоузлов. Вирсунголитиаз. Гепатоспленомегалия. Малое количество жидкости в малом тазу. На основании субъективных, объективных и лабораторно-инструментальных данных был поставлен диагноз: Сахарный диабет на фоне панкреатита в стадии клинико-метаболической декомпенсации (гипогликемическое состояние). Диабетическая ангиопатия нижних конечностей. ИМТ 23 кг/м2, динамика в весе (–) 10 кг в течение полугода.
Рекомендовано лечение:
- Стол Д-П
- Инсулинотерапия – отменить;
- профиль гликемии
- Реополиглюкин 400 мл в/венно-капельно № 4;
- антибактериальное лечение;
- эссецикапс по 2 капс. 3 раза в день после еды;
- панкреатин по 2 табл. 3 раза в день после еды;
- цианокоболамин 500 мкг в/мышечно № 10;
Пациент находился под постоянным наблюдением эндокринолога, уровень глюкозы в крови определялся перед каждым приёмом пищи: 4,5 – 5,1 – 5,8 ммоль/л.
В течение 2-х дней стационарного лечения самочувствие больного улучшилось: появился аппетит, не наблюдались больше диспептические расстройства, гипогликемические состояния, сон стал спокойным.
Дополнительно был назначен диадеон (60 мг) по ½ табл. 2 раза в день под контролем гликемии.
В удовлетворительном состоянии больной был переведен на амбулаторное лечение.
Пример № 2. Больной С., 30 лет, находился на стационарном лечении в хирургическом отделение 3-ей ГКБ г. Минска с диагнозом – острый панкреатит.
Эндокринолог был вызван по поводу гипергликемии. Пациент жаловался на головную боль, сухость во рту, жажду, тошноту, рвоту, чувство тяжести в правом боку, похудание на 4 кг в течение месяца. Считает себя больным сахарным диабетом около месяца, когда при прохождении медицинского осмотра на работе была выявлена гипергликемия (9,6 ммоль/л). К врачу не обращался, перестал употреблять легко усвояемые углеводы.
Самочувствие ухудшилось около недели назад после отравления в столовой: появилась тошнота, рвота, резкие боли в животе, понос. Из перенесенных заболеваний отмечал редкие простудные заболевания. Отец болеет сахарным диабетом, принимает инсулинотерапию.
Объективно: больной правильного телосложения, несколько повышенного питания, рост 170 см, вес 81 кг. Кожные покровы обычной влажности, лицо гиперемировано. Щитовидная железа не увеличена, безболезненна, подвижна при акте глотания. Тоны сердца ясные, Ps – 96 у д. в 1 мин, ритмичен, АД 140/90 мм рт. ст. В лёгких дыхание везикулярное, хрипов нет, ЧД – 16 в 1 мин. Живот мягкий, печень на 2 см выступает из-под правого края рёберной дуги, чувствительна при пальпации пузырная точка. Симптом поколачивания по пояснице слабо положителен с обеих сторон. Стул был вчера, понос. Пульсация на а. tibialis posterior d., s. не ослаблена.. Биохимический анализ крови: билирубин общий – 12,5 мкмоль/л, мочевина – 4,8 ммоль/л; глюкоза – 12,0 ммоль/л, амилаза – 27, АЛТ – 81,1, АСТ – 53,3. Общий анализ крови: Er – 4,6 · 1012/л, Hb – 160 г/л, L – 7,8 ·109 /л, п – 3%, э – 1 %, с. – 61%, л. – 29%, м. – 6 %, СОЭ – 2 мм/час. Общий анализ мочи: с/ж, удельный вес 1011, лейкоциты 6–8/1, белок, сахар –отр, эпит – ед, ацетон – отр. УЗИ органов брюшной полос 129
Рекомендовано лечение:
- Стол Д-П
- диабетон 60 мг по 1 табл. 2 раза в день;
- профиль гликемии
- Реополиглюкин 400 мл в/венно-капельно № 4;
- гептрал по 1 капс. 3 раза в день после еды;
- креон (25 000) по 1 капс. 3 раза в день после еды;
- цианокоболамин 500 мкг в/мышечно № 10;
- но-шпа (0,02) по 2 табл. 3 раза в день.
Пациент находился под постоянным наблюдением эндокринолога, уровень глюкозы в крови определялся перед каждым приёмом пищи: 8,5 – 7,1 – 5, 8 – 6,4 – 5,6 – 4,5 ммоль/л. В течение 5 дней стационарного лечения самочувствие больного улучшилось: появился аппетит, не наблюдались больше диспептические расстройства, перестали беспокоить сухость во рту, жажда, сон стал спокойным. В удовлетворительном состоянии больной был переведен на амбулаторное лечение.
Выше приведенные примеры являются не единичными и иллюстрирует быструю клиникометаболическую компенсацию сахарного диабета при назначении комплексного лечения, основанного на причинно-следственной связи патологического процесса.
Выводы
- Тотальное поражение поджелудочной железы, параллельно идущая патология печени (жировой гепатоз – стеатоз) и желчевыводящих путей играют важную роль в развитии сахарного диабета.
- Следует признать значимую роль печени в повышенной чувствительности к инсулину и развитии частых гипогликемических состояний при остром и хроническом панкреатите. С помощью терапии, основанной на комплексном лечении сахарного диабета, патологии печени и поджелудочной железы, выполнимо более быстрое достижение компенсации заболевания, предупреждение его прогрессирования и развития осложнений.
